

تحليل MTT
fill the form
تحليل MTT ؛ بسيطة ورخيصة وموثوقة في مجال التكنولوجيا الحيوية
مقدمة: أصبح قياس معدل تكاثر الخلايا وبقائها وموتها في ظل ظروف مختلفة أمرا مهما للغاية مع تقدم العلوم البيولوجية. في هذا الصدد، قدم تحليل MTT مساهمة كبيرة في دراسة التوافق الحيوي للمواد المختلفة من خلال توفير نظام قياس الألوان وغير المشع مع أمان عالي. سنحاول في هذه المقالة دراسة هذا التحليل من جوانب مختلفة ونعلمكم كل ما تحتاجون لمعرفته حول هذه الطريقة …
لماذا من الضروري إجراء اختبار السمية الخلوية؟
تتطلب قوانين الصحة التي تحكم العالم اليوم إجراء اختبار السمية الخلوية لاستخدام أي مادة أو أداة صحية تتلامس مباشرة مع البشر. يعد عدم وجود سمية خلوية أحد الشروط الرئيسة لدخول المنتجات المختلفة إلى سوق المعدات الطبية.
اختبارات السمية الخلوية هي اختبارات تتحقق من الآثار غير المرغوب فيها للمركبات المختلفة على الخلايا. تتم هذه العمليات في بيئة خارج جسم الإنسان أو ما يسمى خارج الجسم. تستخدم معظم هذه العمليات أيضا زراعة الخلايا.
يتم اختبار المعدات المختلفة من أجل السمية الخلوية في تحليل MTT، بناء على المعيار الدولي ISO 10993-5، بحيث إذا لم يكن لها تأثيرات سامة، فيمكنهم الحصول على المعايير والتراخيص اللازمة ودخول السوق.
ما هو اختبارMTT؟
اختبار MTT هو الاختبار الأكثر شهرة للتحقق من صلاحية الخلية. الهدف الرئيسي من هذا الاختبار هو التحقق من تأثير السمية للمركبات أو الأدوية أو المكملات الأخرى على الخلية. بالطبع، يمكن أيضا ذكرها في المقالات كعملية للتحقق من تكاثر الخلايا أو العد.
تحليل MTT قادر على التمييز بين الخلايا الحية والميتة من خلال التأثير على العضيات داخل الخلايا. في هذه الطريقة، وبعد الزراعة في المختبر، يتم “معالجة” الخلايا بالمواد المرغوبة من أجل تقييم سميتها.
يتم تحديد صلاحية الخلية في نهاية هذا الاختبار، لكل تركيز للمادة. على الرغم من أن هذه الطريقة مخصصة في الأصل للمحاليل والمركبات القابلة للذوبان في الماء، إلا أنها تُطبق حاليا على المركبات الأخرى القابلة للذوبان في المذيبات العضوية والجسيمات النانوية.
نحو فهم سلوك الخلايا!
يساعد إجراء تحليل MTT على فهم سلوك الخلايا. قد يزيد سلوك وسرعة تكاثر الخلايا أو لا يتغير على الإطلاق تحت تأثير الهرمونات وعوامل النمو والسيتوكينات والميتوجينات. وبالمثل، فإن بعض الأدوية والمواد السامة للخلايا، مثل الأدوية المضادة للسرطان، قد تسبب نخر أو موت الخلايا المبرمج (موت) الخلايا، أو تقلل من سرعة التكاثر والنمو، أو حتى تدمر بنية الخلية. يمكن تقييم العديد من هذه السلوكيات من خلال التحليل الصحيح لاختبار MTT.
قبل معرفة MTT، تعرفوا على الميتوكوندريا!
يعتمد مبدأ تحليل MTT على نشاط الميتوكوندريا (جزء من الخلية). عادة ما تكون أنشطة الميتوكوندريا مستقرة في الخلايا الحية. لذلك، فإن أي تغيير في عدد الخلايا النشطة والحية يرتبط ارتباطا خطيا بنشاط الميتوكوندريا.
يمكن التعبير عن مبادئ اختبار MTT من منظور آخر (وبالطبع أكثر علمية). هذا الاختبار هو طريقة قياس لونية تقوم بالتحليل النهائي بناء على إحياء وكسر البلورات الصفراء من “التترازوليوم” بواسطة إنزيم “سكسينات” المنزوعة الهيدروجين وتكوين بلورات أرجوانية غير قابلة للذوبان. (لا تقلق إذا لم تفهم هذه المصطلحات المعقدة! لأنه في الأجزاء التالية من هذه المقالة، سنشرح لك هذه التعريفات بالتفصيل).
ما هو اختبارMTT؟
في تحليل MTT، على عكس الطرق الأخرى، تمت إزالة خطوات غسل وتجميع الخلايا، والتي عادة ما تسبب فقدان جزء من الخلايا وزيادة خطأ العمل. أي أن جميع مراحل التجربة، من بداية زراعة الخلية إلى قراءة النتائج وتحليلها باستخدام مقياس الضوء، يتم إجراؤها في شكل مضغوط تماما وفي “صفيحة ميكروية”. لذلك، فإن تكرار الاختبار ودقته وحساسيته عالية.
وصف عملية اختبار MTT
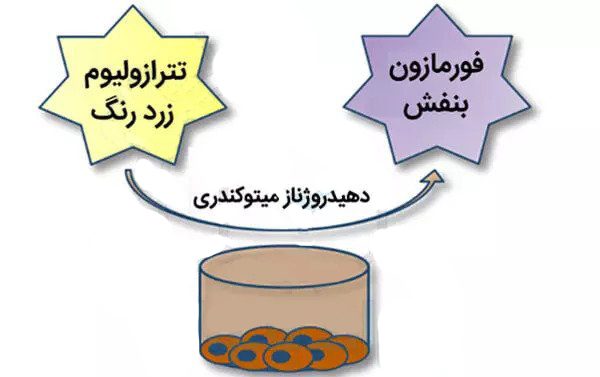
تترازوليوم، مادة جذابة للخلايا
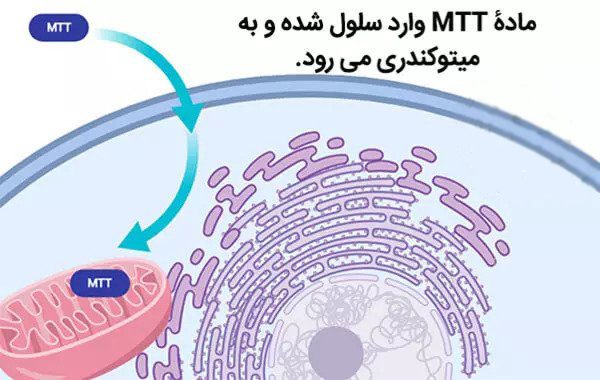
المكون الرئيسي والأساسي لهذا الاختبار هو تترازوليوم (الذي ذكرناه من قبل) في شكل مسحوق وعادة ما تستخدم هذا المحلول مع مادة PBS. هذا المحلول الأصفر شديد الحساسية للضوء. أيضا، نظرا لوجود شحنة موجبة صافية، يمتصها غشاء الخلية. ثم يدخل الخلايا من خلال عملية الإدخال الخلوي (Endocytosis) ويذهب إلى الميتوكوندريا.
يتم تحويل هذه المادة إلى رواسب أرجوانية غير قابلة للذوبان في الماء في الميتوكوندريا بواسطة إنزيم “نازعة هيدروجين السكسينات”، والذي ينشط فقط في السلسلة التنفسية للخلايا الحية. النقطة المثيرة للاهتمام هي أنه من بين العدد الكبير من الخلايا الموجودة، يمكن للخلايا الحية فقط تحويل محلول MTT إلى راسب أرجواني “فرومازون” غير قابل للذوبان في الماء.
الكشف عن الاختلاف في شدة اللون في اختبار MTT
لقد فهمنا حتى الآن أنه إذا كانت الخلايا الموجودة في لوحة الجهاز على قيد الحياة، فسوف تتحول إلى اللون الأرجواني تحت تأثير MTT. ولكن كيف نميز الفرق في شدة اللون في الصفيحات؟
يمكن قياس الكثافة الضوئية للمحلول الناتج باستخدام جهاز مقياس طيف ضوئي بطول موجة 579 نانومترا وطول موجي أساسي يبلغ 630 نانومترا.
نظرا لحقيقة أن تفاعل إحياء MTT مع فرومازون يحدث فقط في الخلايا الحية وأن الخلايا الحية تحتوي أيضا على إنزيم نازعة الهيدروجين النشط، وبالتالي فإن القيمة العددية التي تم الحصول عليها من هذه التقنية مرتبطة ارتباطا مباشرا بعدد الخلايا الحية.
لذلك، أنه في اختبار MTT، تتم مقارنة كمية الفورمازون التي تنتجها الخلايا المعالجة بمعدات أو أدوية خاصة بكمية الفورمازون التي تنتجها خلايا التحكم التي لم تتلق الأدوية. من هذه المقارنة، يحددون تأثير هذا العامل الخاص على موت وتثبيط نمو الخلايا.
من الواضح أنه كلما انخفضت معدل امتصاصية مقارنة بحالة التحكم، يمكن استنتاج أن عدد الخلايا الحية قد انخفض وحدث تثبيط أكثر للنمو.
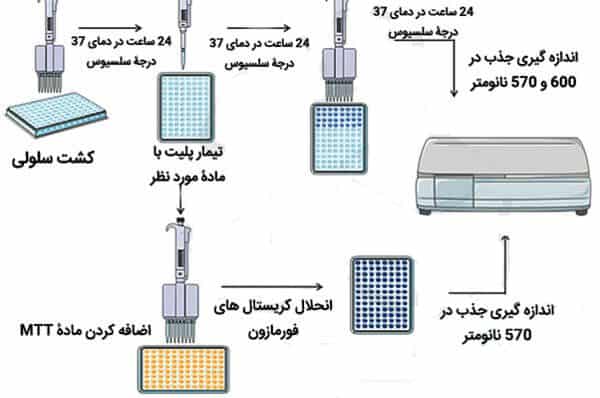
كيف نجري اختبارMTT؟
والآن، نريد أن نتعلم كيفية إجراء هذا الاختبار. تحتوي هذه التجربة على 3 مراحل رئيسة بما في ذلك زراعة الخلايا (Seeding) والعلاج (Treatment) وأخيرا تحليل MTT نفسه. عادة ما تستغرق كل خطوة من هذه الخطوات يوما. أيضا، اعتمادا على نوع الخلية والعقار، يمكن أن يكون عدد أيام MTT بعد 24 أو 48 أو 72 ساعة من يوم العلاج (Treatment).
إذا تم إجراء التحليل على الخلايا الملامسة للصفيحة وبصورة مستمرة، فيجب أولا زراعة عدد مناسب من الخلايا في كل من آبار جهاز تحليل MTT. وبعد ذلك، في غضون 24 ساعة، لازم أن يسمح للخلايا بالالتصاق بأسفل اللوحة واستقرارها.
ثم نختار آبار التحكم (Blank ,C+) والاختبار ونضيف الكمية المناسبة من مادة ميتوجين أو الدواء المطلوب إلى آبار الاختبار. نضع الصفيحة في الحاضنة في الوقت المطلوب بحيث تؤثر المادة المرغوبة على الخلايا.
بعد فترة الحضانة، نتخلص من محيط الزرع، ونضيف 200 ميكرولتر من محيط الزرع والذي يحتوي على نصف مليغرام، وهذا لكل مليلتر من محلول MTT لكل بئر، ونضعه مرة أخرى لمدة 2 إلى 4 ساعات في حاضنة ثاني أكسيد الكربون عند 37 درجة مئوية.
ماذا يحدث في حضانة اختبارMTT؟
خلال فترة الحضانة، يتم تجديد مادة MTT بواسطة نظام نازعة الهيدروجين السكسينات، والذي قلنا أنه أحد إنزيمات الدورة التنفسية للميتوكوندريا. يؤدي إحياء هذه الحلقة وتحليلها إلى إنتاج بلورات فورمازون أرجوانية والتي يمكن التعرف عليها بسهولة تحت المجهر.
قلنا أن كمية اللون التي يتم إنتاجها ترتبط ارتباطا مباشرا بعدد الخلايا النشطة الأيضية (الخلايا الحية). ولكن، لم نذكر النقطة المهمة هذه أن بلورات فورمازون غير قابلة للذوبان في الماء ويجب إذابتها بمذيب مثل ثنائي ميثيل سلفوكسيد (DMSO) قبل قياس الألوان.
معدات تحليل MTT
الأداة العملية الرئيسة في تحليل MTT هي جهاز (Eliza Reader)، والتي سنقدمها بإيجاز. الأجزاء الأخرى الشائعة لهذا الاختبار هي أدوات زراعة الخلايا، وأهمها هي:
- غطاء للمختبر من الدرجة الثانية (II): مزود بفلتر رقائقي في الأعلى ومصباح للأشعة فوق البنفسجية لتعقيم الغطاء.
- حاضنة CO2: الرطوبة 95٪، ودرجة الحرارة 37 درجة مئوية وثاني أكسيد الكربون 5٪
- الأوتوكلاف: تعقيم العبوات الزجاجية
- بن ماري: لتسخين محيط الزرع وفتح العينة المجمدة
- مجهر بصري invert: مراقبة الخلايا في الدورق
- جهاز الطرد المركزي: لفصل الخلايا
جهاز Eliza Reader لاختبار MTT
جهاز (Eliza Reader) نوع من أجهزة قراءة الأطباق الدقيقة. تم تصميم مقياس الطيف الضوئي هذا لقراءة نتائج اختبار MTT. في هذا الجهاز، يتم تحديد وجود أي جسم مضاد أو مستضد في العينة بشكل مباشر أو بواسطة علامة ثانوية على السطح الصلب. وفي نهاية المطاف، تتم قراءة امتصاص ناتج التفاعل باستخدام مقياس الطيف الضوئي لهذا الجهاز.

ما مدى موثوقية اختبارMTT؟
باختصار، يجب أن نقول أن طريقة التحليل هذه هي واحدة من أكثر الطرق موثوقية في التكنولوجيا الحيوية. واللافت للنظر والذي جعل تركيب MTT عاملا مناسبا للتحقق من صلاحية (Viability) الخلايا هو القدرة على التمييز بدقة بين الخلايا الحية والميتة.
علاوة على ذلك، تمتص هذه المادة الضوء في نطاق معين من الطول الموجي. لذلك، يمكن أن تكون طريقة دقيقة للغاية للتحقق من نشاط الخلايا. ولكن، لنكن صادقين، أنه في بعض الأحيان يكون للجمع بين مادة MTT والمادة التي يتم اختبار السمية بها تداخلات. وتسبب هذه التداخلات اضطرابات في نتيجة اختبار MTT.
في هذه الحالات، تعتبر المركبات مثل LDH، XTT و ريسازورين (Resazurin) بدائل مناسبة لإجراء اختبار MTT. ولكن، تجدر الإشارة إلى أن كل مادة من هذه المواد لها ظروفها الخاصة وسيكون لها امتصاص مختلف للضوء، وهو ما يجب مراعاته عند تحليل نتائجها.
فحص نتائج اختبار MTT
وبكلمات بسيطة، إذا لم يكن هناك فرق كبير بين مجموعات خلايا التحكم والمعالجة من حيث نمو الخلايا، فيمكن الاستنتاج أن الأداة المعنية لا تحتوي على سمية خلوية. ولكن إذا رأينا انخفاضا كبيرا في حياة الخلية في خلايا العلاج الأولية، فيمكن أن نستنتج أن العامل المختبَر لديه سمية خلوية.
يتم حساب متوسط معظم فحوصات الصلاحية، مثل اختبار MTT، بعد قراءة الصفيحة بجهاز إليزاريدر، من امتصاص الخانات المكررة لكل جرعة (doze). يجب الانتباه إلى أنه يجب تقليل كمية الامتصاص لكل بئر من كمية امتصاص البئر الفارغ. وبالطبع، يتم ذلك بواسطة جهاز إيلازار ريدر نفسه.
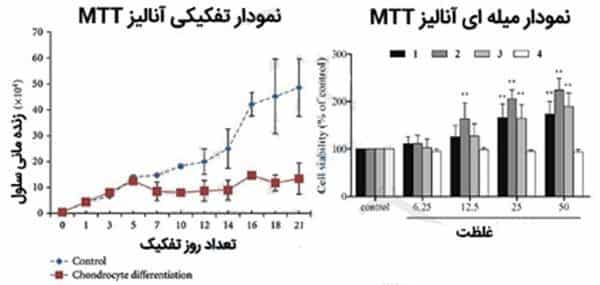
وأخيرا، يُقسم متوسط الامتصاص لكل جرعة على معدل امتصاص تحكم المقسم وضربها في 100. تظهر الأرقام النسبة المئوية للصلاحية أو Viability نفسه. ثم، يتم رسم معدل البقاء لكل تركيز في شكل الرسم البياني ويتم تفسير النتائج وتحليلها بناء على الرسم البياني.
استخدامات تحليل MTT
معظم الأشخاص الذين يعملون أو يبحثون في المختبرات الخلوية يتعاملون مع هذا الجهاز. بالإضافة إلى ذلك، قد يستخدم الباحثون العاملون في مجال الأدوية أيضا اختبار MTT.
يعد تحليل MTT هو الاختبار الأكثر شيوعا والأكثر استخداما بين التقنيات الخلوية في مختبرات الجامعات الإيرانية. يجب على الطلاب المهتمين بالمشاريع الصيدلانية والخلوية أن يكونوا بارعين في تنفيذ وتحليل نتائج هذه التقنية.
الاستخدام الرئيسي لهذا الاختبار هو قياس معدل تكاثر الخلايا في مواجهة العوامل المختلفة وتحديد مقدار سمية هذه العوامل، عندما يكون لهذه العوامل تأثير على الخلايا. يعد اختبار MTT أحد طرق قياس الكلور التي تقدر بدقة موت الخلية وهي قادرة على اكتشاف موت الخلايا في المراحل المتأخرة جدا من “موت الخلايا المبرمج” عندما ينخفض التمثيل الغذائي للخلايا.
اختبار MTT موصى به من قبل معظم الخبراء البيولوجيين للحصول على نسبة الصلاحية(Viability) متأثرا من الأدوية والمواد المختلفة. أتاح هذا الاختبار، في منتهى البساطة، الحصول بسرعة على سمية المواد والحصول على IC50. ( 50IC تعني التركيز الذي تموت فيه نصف الخلايا).
النقاط الرئيسة في تنفيذ اختبار MTT
- التأكد من العمل بدقة وتركيز كافيين في الاختبار، وإجراء الحسابات بدقة.
- يجب زراعة عدد محدد ومحدود من الخلايا في آبار لوحة الجهاز، ويجب ألا يكون أقل أو أكثر من الحد المسموح به.
- يجب أن يكون عدد الخلايا في كل بئر بين 103 و 105 خلية.
- يعد العد الصحيح للخلايا لكل بئر أمرا حيويا وضروريا للغاية.
- من الأفضل أن يكون محلول الخلية موحدا ومتجانسا بحيث تظل كثافة الخلايا في كل بئر كما هي، ويتم تحديد تأثير الدواء على مجموعة الخلايا بشكل أكثر دقة.
- كرروا الاختبار ثلاث مرات على الأقل لكل نوع من الخلية لكي تقلل احتمالية الخطأ.
لاحظوا أن كل عقار له مدة تأثير مختلفة. تسري بعض الأدوية في غضون ساعات قليلة والبعض الآخر في غضون أيام قليلة. يمكن العثور على هذه الفترة الزمنية التقريبية من المقالات. وفي غير هذا، يمكن للمستخدم نفسه محاولة أوقات مختلفة. (بالطبع، إذا كان لديه وقت إضافي!).
المصادر والمراجع
“Why should I use XTT instead of MTT” (PDF, 0.1 MB). [aniara.com]. ANIARA. Retrieved 2010-11-19.
Stockert JC, Blázquez-Castro A, Cañete M, Horobin RW, Villanueva A (December 2012). “MTT assay for cell viability: Intracellular localization of the formazan product is in lipid droplets”. Acta Histochemica. 114 (8): 785–96. doi:10.1016/j.acthis.2012.01.006. PMID 22341561.
Cory AH, Owen TC, Barltrop JA, Cory JG (July 1991). “Use of an aqueous soluble tetrazolium/formazan assay for cell growth assays in culture”. Cancer Communications. 3 (7): 207–12. doi:10.3727/095535491820873191. PMID 1867954.



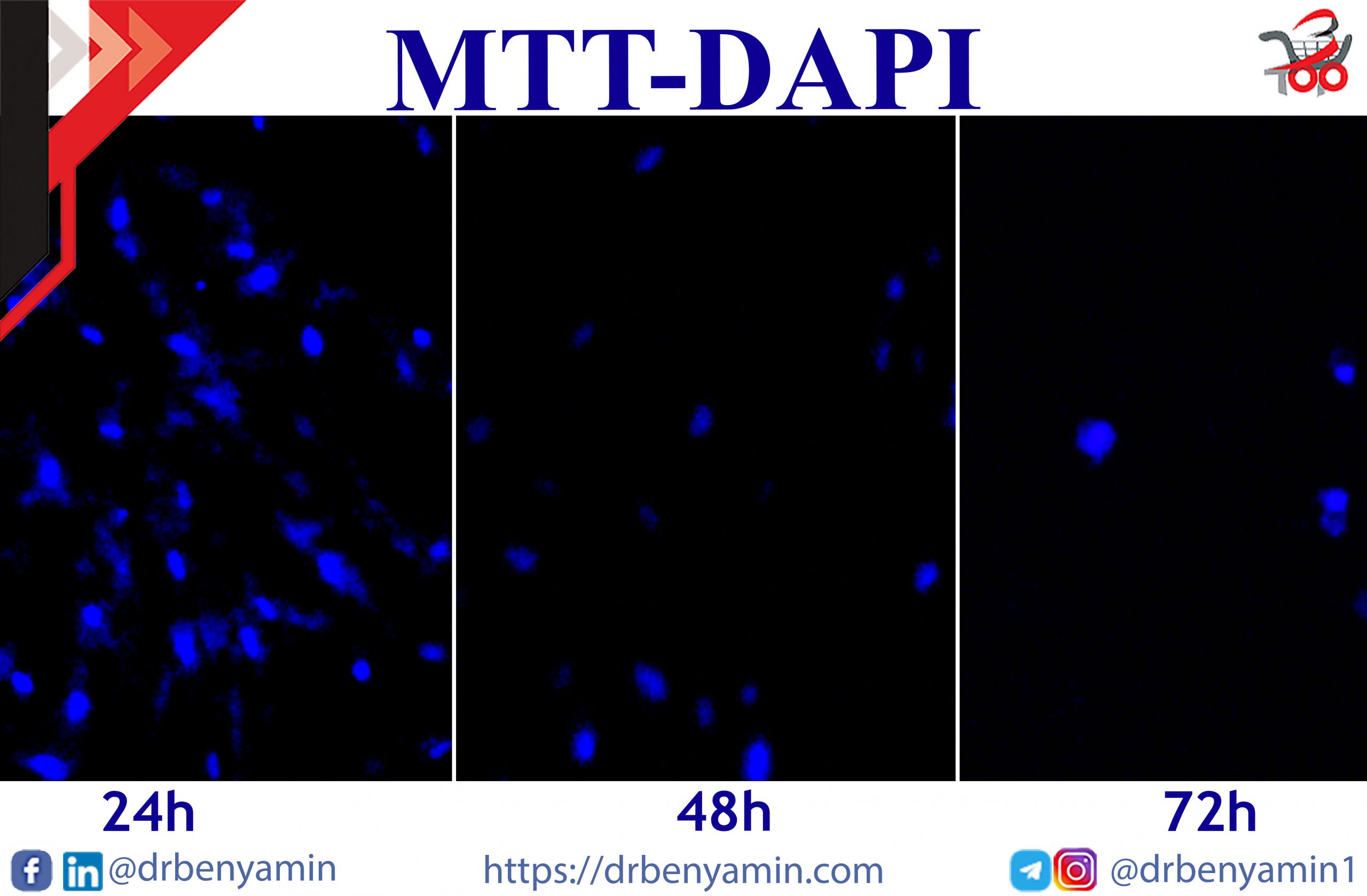



المراجعات
مسح الفلاترلا توجد مراجعات بعد.