تحليل Atomic absorption
$5.00
مطيافية الامتصاص الذري (AAS)
التحليل الطيفي هو طريقة لدراسة التفاعل بين الضوء والمادة. من وجهة نظر تاريخية ، فإن التحليل الطيفي هو فرع من فروع العلم حيث تستخدم الموجات للدراسات النظرية حول بنية المادة والتحليلات النوعية والكمية. وفي الوقت نفسه ، فإن التحليل الطيفي للامتصاص الذري ، أو تحليل AAS باختصار ، هو طريقة طيفية للقياس الكمي للعناصر الكيميائية باستخدام امتصاص أشعة الضوء بواسطة الذرات في الحالة الغازية. في الكيمياء التحليلية وهندسة المواد ، تُستخدم هذه التقنية لتحديد تركيز عنصر معين في عينة. في هذه المقالة ، سوف نتعلم المزيد عن طريقة التحليل هذه.
ما المقصود بطيف الامتصاص الذري؟
طيف الامتصاص لعنصر في شكله الغازي والذري عبارة عن سلسلة من الخطوط الضيقة المحددة بوضوح والتي تنشأ من قفزات الإلكترونات في الإلكترونات الخارجية. تمتص إلكترونات طبقة التكافؤ في الذرة أو تنبعث منها الإشعاع الكهرومغناطيسي في نطاق الأشعة فوق البنفسجية والمرئي.
في الذرات الحرة ، على عكس الجزيئات التي لها مستويات طاقة اهتزازية ودورانية ، تحدث قفزات إلكترونية فقط. لهذا السبب، عندما يتم امتصاص الطاقة أو انبعاثها بواسطة الذرات ، يتم ملاحظة خطوط طيفية منفصلة. هذه الظاهرة هي أساس طرق التحليل الطيفي الذري.
الامتصاص الضيق أو ذروة الانبعاث التي لوحظت أثناء الامتصاص الذري أو التحليل الطيفي للانبعاثات تسمى الأطياف الخطية. الجزيئات والأيونات متعددة الذرات لها نطاقات امتصاص واسعة ؛ بينما تحتوي الذرات على خطوط امتصاص ضيقة (عادة من 0.001 إلى 0.01 نانومتر).
الشيء الوحيد الذي نحتاج إلى معرفته في التحليل الطيفي للمواد هو تأثيرات التوسيع لخطوط الامتصاص. يميل التأثيران التاليان إلى توسيع خطوط امتصاص الذرات بمقدار 0.02 إلى 0.05 أنجستروم:
توسيع دوبلر:
ينتج عن الحركة السريعة لجسيمات الامتصاص بالنسبة لمصدر الانبعاث. بالنسبة للذرات التي تتحرك نحو المصدر ، يتم تقليل الطول الموجي للإشعاع بشكل فعال من خلال تأثير دوبلر. لذلك ، يتم امتصاص أطوال موجية أطول قليلاً. ينطبق عكس هذه المشكلة أيضًا على ابتعاد الذرات عن المصدر. ببساطة ، يوضح تأثير دوبلر أنه اعتمادًا على ما إذا كان المراقب يتحرك باتجاه المصدر أو بعيدًا عنه ، فإنه يتلقى أكثر أو أقل من التردد (أو بعبارة أخرى الطول الموجي) المنبعث من المصدر.
توسيع الضغط:
يؤدي التصادم بين الذرات إلى تغيرات طفيفة في مستويات الطاقة في الحالة الطبيعية ، ونتيجة لذلك تتسع القمم.
تعرف على مطيافية الامتصاص الذري (AAS)
بكلمات بسيطة ، التحليل الطيفي أو التحليل الطيفي هو دراسة المواد وخصائصها من خلال دراسة الضوء والصوت والجسيمات المنبعثة أو الممتصة أو المتناثرة من عينة الاختبار. بمعنى آخر ، يتم تعريف التحليل الطيفي أيضًا على أنه دراسة التفاعل بين الضوء والمادة.
يعد التحليل الطيفي للامتصاص الذري إحدى الطرق الطيفية التي يمكن استخدامها لتحديد تركيز العناصر المعدنية في عينة بدقة عالية. مطيافية الامتصاص الذري هي تقنية لتحديد وقياس التركيب الأولي للعينة من خلال دراسة الطاقة المشعة بواسطة الذرات. يعتمد أساس هذه الطريقة على مبدأ أن كمية الإشعاع الممتص عند المرور عبر العينة يتناسب مع تركيز العنصر المطلوب.
هذه الطريقة لديها القدرة على تحليل حوالي 75 عنصرًا معدنيًا وشبه معدني ؛ لكنها لا تملك القدرة على تحليل المواد غير المعدنية بشكل صحيح. في الشكل أدناه ، يمكننا أن نرى الجزء الخارجي من محلل AAS.

مطيافية الامتصاص الذري (AAS)
لمعرفة المزيد حول أساس هذه الطريقة ، من الأفضل مراجعة النظرية الأساسية لتحليل AAS أولاً. تنص هذه النظرية على ما يلي:
- يمكن لجميع الذرات دون استثناء امتصاص الضوء.
- الطول الموجي للضوء الذي يتم امتصاصه يختلف لكل عنصر ويكون محددًا لنفس العنصر. لذلك ، فإن الطول الموجي لامتصاص عنصرين لا يتساوى أبدًا.
- كمية الضوء التي تمتصها العناصر تعتمد بشكل مباشر على تركيز الذرات الممتصة للضوء ، أو بعبارة أخرى ، تركيز العنصر المطلوب في عينة المحلول.
أساس تحليل AAS هو استخدام جهاز امتصاص لتقييم تركيز المادة التحليلية في العينة ؛ لذلك ، نحتاج إلى علاقة بين كمية الضوء التي تمتصها العينة وتركيز العينة ، وهو “قانون بير لامبرت”. يعبر هذا القانون التجريبي عن العلاقة بين شدة الضوء الممتص الذي يمر عبر مادة متجانسة دون تشتت وخصائص المادة. نص هذا القانون على النحو التالي:

باختصار ، يمكن أن تنتقل إلكترونات الذرات إلى مستويات طاقة أعلى بامتصاص طول موجي معين (طاقة) وتصبح متحمسة لفترة قصيرة. نحن نعلم أن هذه الكمية من الطاقة الممتصة تختلف من ذرة إلى أخرى.
بمعنى آخر ، كل عنصر يستجيب فقط لطول موجي معين. يؤدي ضيق شعاع الضوء في هذه الطريقة إلى إنتاج طاقة معينة وهذه الطريقة دقيقة للغاية ويمكن اختيارها. عندما تعود الذرة المثارة إلى الحالة الأساسية ، فإنها تصدر طولًا موجيًا محددًا. بقياس امتصاص العينة ورسم منحنى المعايرة وقانون بير لامبرت ، نأخذ الكمية غير المعروفة في العينة.
في التحليل الطيفي للامتصاص الذري ، يجب تقليل المادة قيد الدراسة إلى حالتها الأولية ، وتبخيرها ووضعها في مسار مصدر الإشعاع. من الضروري معرفة أنه في هذه العملية ، يجب حل العينات.
في الخطوة الأولى من الاختبار ، يتبخر المحلول المحتوي على العنصر المطلوب بواسطة لهب يحترق بالهواء والأسيتيلين ، على سبيل المثال ، عند درجة حرارة أقل من طيف إشعاع العنصر. نتيجة للتبخر ، تصبح معظم العناصر الموجودة في المحلول محايدة ويتم امتصاص الشعاع المنبعث من مصابيح الكاثود (مصباح خاص لكل عنصر) بواسطة الذرات المتعادلة.
في هذه الحالة ، تنخفض شدة الإشعاع الأولي. الفرق في شدة الأشعة المنبعثة والمخرجة هو مقياس لتركيز العناصر في المحلول.
العيب الرئيسي لهذه التقنية هو الحاجة إلى مصباح مصدر منفصل لكل عنصر ليتم تحليله. لحل هذا القصور ، تم بذل جهود لاستخدام مصدر مستمر إلى جانب جهاز أحادي اللون بقوة فصل عالية جدًا. يتم وضع أحادي اللون أمام مصدر الضوء ويمرر الطول الموجي المطلوب. بالطبع ، هذه التقنية ليست مرضية مثل استخدام مصباح خاص لكل عنصر. يوضح الشكل أدناه طيف الامتصاص الذري للكلوروفيل الذي تم الحصول عليه من تحليل AAS.
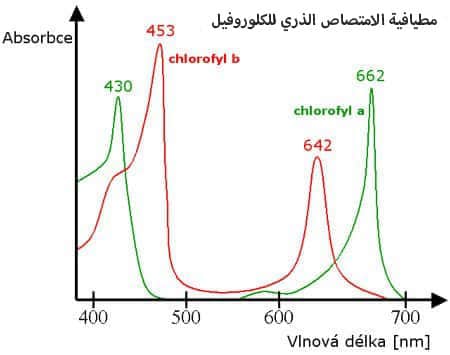
مطيافية الامتصاص الذري للكلوروفيل
ما هي مراحل تحليل AAS؟
من أجل تحديد تركيز المادة المرغوبة بواسطة مطيافية الامتصاص الذري ، يجب تنفيذ الخطوات التالية:
- تحضير محلول فارغ (محلول يحتوي على جميع الأنواع باستثناء العينة المستهدفة.)
- تحضير عينات قياسية من الأنواع المرغوبة بتركيزات محددة
- قراءة الامتصاص للحلول القياسية 4
- رسم الامتصاصية حسب التركيزات المعيارية والحصول على مخطط المعايرة
- قياس امتصاص المحلول المجهول والحصول على التركيز المجهول من الرسم البياني
أولاً ، يجب وضع المحلول الفارغ في الخلية وإغلاق فجوة مصدر الإشعاع لضبط امتصاص بنسبة 100٪ أو انتقال 0٪. بعد ذلك ، يتم فتح فجوة مصدر الإشعاع لضبط الإرسال بنسبة 100٪ أو امتصاص 0٪. بعد ضبط الصفر و 100 ، يتم قياس امتصاص المحاليل القياسية وكذلك المحلول غير المعروف.
بشكل عام ، هناك طريقتان شائعتان في التحليل الكمي ، وهما:
- طريقة مخطط العمل: أولاً ، يتم إعداد الحلول القياسية ذات التركيزات المناسبة والتحليل الخطي بنفس طريقة تحضير محلول العينة. بعد ذلك ، بعد ضبط الامتصاص الصفري بواسطة المحلول الفارغ ، تتم قراءة امتصاص المحاليل القياسية وتسجيله بواسطة الجهاز بالترتيب من المخفف إلى السميك. في النهاية ، يتم أيضًا تسجيل امتصاص المحلول المجهول في نفس الظروف.
ثم يتم رسم الرسم البياني للامتصاص وفقًا لتركيز المحاليل القياسية ويتم تمييز الامتصاص المقابل للمحلول المجهول عليه ويتم تحديد تركيزه. في هذه الحالة ، تتراوح دقة النتائج بين 2 إلى 5 بالمائة ودقتها في نطاق 0.1 إلى 2.0 بالمائة.
- طريقة الزيادة المعيارية المتعددة: طريقة أخرى أكثر دقة هي الزيادة القياسية المتعددة. في طريقة الإضافة المعيارية المتعددة ، يتم إضافة أحجام مختلفة من المحلول القياسي إلى حجم معين من المحلول المجهول (التركيز X) ، ثم يتم سحب امتصاص هذه المحاليل وفقًا للتركيز ، ومن خلال ذلك يتم سحب تركيز المجهول يتم الحصول على الحل.
ما هو الأجزاء التي يتكون منها جهاز AAS؟
يحتوي هذا الجهاز على 4 أجزاء أساسية سنذكرها أدناه:
- مصدر الإشعاع: يجب أن يكون كل مصدر إشعاع قادرًا على إصدار الخط الطيفي (الطول الموجي) للعنصر المطلوب ، وله شدة طيفية عالية في مركز الطيف الخطي للعنصر ، ولديه موصلية ضوئية عالية ، ويجب أن يكون شدة إشعاعه ثابتًا لفترة طويلة. بمعنى آخر ، يجب أن يكون مصدر الإشعاع قادرًا على إنتاج حزمة من الإشعاع بقوة كافية وثابتة للتحليل المطلوب.
- المرذاذ (Atomizer): يتم امتصاص الضوء المنبعث من مصدر الإشعاع بواسطة الذرات الحرة لعنصر في الحالة الغازية. تتمثل المهمة الرئيسية للمرذاذ في إنتاج ذرات حرة من الجزيئات أو الأيونات في العينة. هذا الجزء مهم جدًا لجهاز AAS ؛ لأن حساسية القياس تتناسب طرديا مع انحلال المادة التحليلية في العينة وبالتالي كفاءة المرذاذ. (Atomizer) يمكن رؤية صورة نوعين من البخاخات في الشكل أدناه.
- Monochromator (محدد الطول الموجي): بشكل عام ، يقوم Monochrome أو أحادي اللون بتحويل الحزمة متعددة الألوان إلى حزمة أحادية اللون. تتم هذه العملية عادةً باستخدام منشور وشبكة أو مقضب.
تتمثل المهمة الرئيسية للمونوكروميتور في مطيافية الامتصاص الذري في فصل الطول الموجي المطلوب (إشعاع الرنين لعنصر الكاثود) عن باقي خطوط الانبعاث التي تنبعث منها المواد الموجودة في الكاثود أو غاز الملء لمصدر الإشعاع.
- الكاشف: تقيس الكاشفات الإشارة الضوئية عند طول موجي محدد. بهذه الطريقة ، يقومون بتحويل شدة الضوء المستلمة من أحادية اللون إلى طاقة كهربائية. الكواشف الأكثر شيوعًا المستخدمة في مطيافية الامتصاص الذري هي الأنابيب المضاعفة الضوئية أو PMTs.
أساس عمل PMT هو استخدام الظاهرة الكهروضوئية ، حيث يصدر الإلكترون حزمة كهرومغناطيسية بعد امتصاص الطاقة. تتراوح قدرة الكشف عن PMT في نطاق الضوء المرئي والأشعة فوق البنفسجية والأشعة تحت الحمراء القريبة (200 إلى 800 نانومتر).
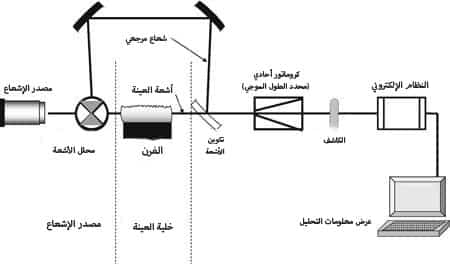
رسم تخطيطي لمطياف الامتصاص الذري (AAS)
ما هي المشاكل الشائعة في تحليل AAS؟
المشاكل الشائعة التي تنشأ في طريقة التحليل الطيفي الذري هي ثلاث فئات:
- الاضطراب الكيميائي: ينشأ من التفاعلات التي حدثت. نظرًا لاستهلاك بعض العناصر المتحللة في اللهب ، فإن عدد العناصر التي يجب أن تمتص الإشعاع يتناقص ونتيجة لذلك ينخفض الامتصاص.
من بين الاضطرابات الكيميائية تكوين أكاسيد حرارية في اللهب مع وجود الأكسجين. مثل تحول الألمنيوم والحديد إلى أكاسيد حرارية Al2O3 و Fe2O3 في وجود الأكسجين. تتمثل إحدى طرق تقليل الإزعاج الكيميائي في استخدام ألسنة اللهب عالية الحرارة ، مثل أكسيد النيتروز ولهب الأسيتيلين بدلاً من لهب الأسيتيلين الهوائي. في هذا اللهب ، بالإضافة إلى ارتفاع درجة الحرارة ، فهو فعال في إزالة الإزعاج الكيميائي عن طريق تقليل تركيز الأكسجين.
هناك طريقة أخرى لإزالة التداخل الكيميائي وهي إضافة “عامل إطلاق” إلى العينة التي تم تحليلها. العامل المطلق هو مادة تتفاعل مع واحد أو أكثر من العوامل المتداخلة وتنتج مركبات غير مقاومة للحرارة وتمنع تكوين أكاسيد حرارية. على سبيل المثال ، لقياس الكالسيوم في وجود الفوسفات ، يتم دمج ملح اللانثانم مع الفوسفات ويمنع تكوين مركب حراري.
- اضطراب التأين: يحدث عندما يتأين عدد كبير من الذرات في اللهب ويؤدي إلى انخفاض في الذرات التي تمتص الإشعاع. نظرًا لأن الأيونات لا تمتص عند الطول الموجي الذي يتم اختباره للعنصر الذي يتم تحليله ، يتم تقليل الامتصاص.
عادة ، يحدث التأين بسبب ارتفاع درجة حرارة اللهب ويتم توفير طاقة التأين بواسطة حرارة اللهب. يحدث التداخل الطيفي عندما يمتص عنصران أو عنصر واحد أو مركب متعدد الذرات داخل الخلية أو ينبعث عند الطول الموجي المطلوب. إذا امتص المركب المسبب للتداخل الإشعاع ، فإنه يؤدي إلى خطأ إيجابي ، وإذا كان يصدر إشعاعًا ، فإنه يتسبب في خطأ سلبي.
- اضطراب الخلفية: يحدث عادةً بسبب امتصاص الأنواع المتعددة الذرات أو تشتت الإشعاع داخل الخلية ، ولا يمكن استخدام طريقة التحسين القياسية لإزالته. لإزالة تداخل الخلفية ، من الضروري تحديد امتصاص الخلفية وطرحه من الامتصاص الكلي للحصول على الامتصاص المصحح للتحليل.
ما هي قدرات وقيود تحليل AAS؟
- تحديد كميات قليلة من المعادن في السوائل
- تحليل السبائك والشوائب الموجودة فيه
- تحليلات الملوثات البيئية (الماء والهواء والتربة)
- التحقيق في تأثير العناصر المختلفة في البيئة
- تحليل عينات التربة في الجيولوجيا
- تحليل المعادن وشبه المعادن في المركبات المعدنية الطبيعية والاصطناعية
- تحديد وقياس العناصر في عينات مختلفة من النفط والغاز والصناعات البتروكيماوية
- تحديد وقياس العناصر في المحفزات المختلفة
- التحقيق في تأثير نوع وكمية المعادن في جميع أنواع التفاعلات
- قياس العناصر وتأثيراتها في النظم البيولوجية
- قياس العناصر في عينات الصناعات الغذائية المختلفة
- مراقبة المعايير المختلفة من قبل إدارة المعايير
لكن هذا الجهاز به أيضًا قيود نذكرها في بعض الأشياء:
- يتراوح نطاق الكشف من حوالي جزء في المليار إلى أجزاء في المليون.
- ليس لديها القدرة على التحليل المباشر للغازات النبيلة أو الهالوجينات أو الكبريت أو الكربون أو النيتروجين.
- تكون حساسيته ضعيفة في حالة الأكاسيد المقاومة للحرارة أو العناصر الموجودة في الكربيدات مقارنة بالطريقة الطيفية من خلال انبعاث البلازما الذري.
- يمكن استخدام هذه الطريقة فقط للعناصر المعدنية وشبه المعدنية ولا تنطبق على العناصر غير المعدنية.
استنتاج
وفقًا للمادة المذكورة ، نجد أن التحليل الطيفي للامتصاص الذري في الوقت الحاضر هو طريقة غير عادية مع تطبيق متعدد الأغراض في الكيمياء التحليلية وعلوم المواد. إن تحديد تركيز العناصر النزرة السامة في مياه الشرب وبعض العناصر الشائعة الأخرى ، مثل الكالسيوم والصوديوم ، بالإضافة إلى كميات صغيرة جدًا من تركيز المعادن الأخرى ، ما هي إلا عدد قليل من التطبيقات العديدة لهذا الجهاز ، مما يجعله أداة قوية للكشف عن الذرات والتحليل العنصري.













المراجعات
مسح الفلاترلا توجد مراجعات بعد.