الكروماتوغرافيا السائلة عالية الأداء (HPLC) هي طريقة مناسبة لفصل المواد وقياسها وتحديدها. هذه التقنية ، جنبًا إلى جنب مع طرق أخرى وأجهزة الكشف المتقدمة مثل مطياف الكتلة ، لها العديد من التطبيقات في مختلف العلوم. يعد اختيار المرحلة المتنقلة والثابتة واختيار الكاشف وتحديد معدل تدفق الطور المتحرك من بين الأشياء الأساسية في إعدادات طريقة HPLC المناسبة. في هذه المقالة ، تتم مناقشة الطرق الممكنة لفصل الجسيمات النانوية في منتصف هذه الإستراتيجية.
تتضمن هذه المقالة العناوين التالية:
1 المقدمة
2- أنواع طرق HPLC
1-2- كروماتوغرافيا الطور الطبيعي
2-2- كروماتوغرافيا الطور العكسي (HPLC RP أو RPLC)
3-2- كروماتوغرافيا التبادل الأيوني
4-2- كروماتوغرافيا (SEC)
3- جهاز HPLC
4- استخدام جهاز HPLC في تحليل جزيئات الذهب النانوية
1- مقدمه
يعد الكروماتوغرافيا السائلة عالية الأداء أحد أكثر طرق الكروماتوغرافيا استخدامًا على نطاق واسع. تُعرَّف العملية الكروماتوغرافية بأنها طريقة فصل تتضمن نقلًا جماعيًا بين طور ثابت ومرحلة متنقلة. باستخدام الطور المتحرك السائل ، تفصل طريقة HPLC مكونات الخليط في المرحلة الثابتة. يمكن أن تكون المرحلة الثابتة سائلة أو صلبة. يتم إذابة المركبات أولاً في مذيب. ثم يتدفقون إلى عمود كروماتوجرافي عالي الضغط. في العمود ، يتم فصل مكونات الخليط. درجة الدقة مهمة للغاية وتعتمد على درجة التفاعل بين المركبات الذائبة والمرحلة الثابتة. يتم تعريف المرحلة الثابتة على أنها المادة المكثفة داخل العمود. يمكن تغيير تفاعل المذاب مع المراحل المتنقلة والثابتة باختيار مذيبات مختلفة ومراحل ثابتة. نتيجة لذلك ، يوفر HPLC درجة عالية من الفصل لا يمكن العثور عليها في طرق كروماتوغرافيا أخرى ويمكنه بسهولة فصل مجموعة واسعة من المخاليط الكيميائية.
HPLC هي عملية امتزاز سطحي ديناميكي. الجزيئات المراد تحللها يتم امتصاصها على السطح أثناء تحركها عبر حبيبات مسامية كثيفة. اعتمادًا على طريقة HPLC ، قد تكون أنواع مختلفة من قوى امتصاص السطح فعالة في عملية التثبيط. التفاعلات الكارهة للماء (غير المحددة) ، التفاعلات الرئيسية في فصل الطور العكسي ، التفاعلات ثنائية القطب (القطبية) ، التفاعل الرئيسي في طريقة الطور الطبيعي ، والتفاعلات الأيونية في كروماتوغرافيا التبادل الأيوني تسبب أيضًا تثبيط المركبات. التفاعلات المذكورة تعمل جميعها في منافسة مع بعضها البعض. تتنافس الجزيئات المراد تحللها مع جزيئات مذيب المنظف لامتصاص السطح في المواقع النشطة للمرحلة الثابتة. لذلك ، كلما زاد عدد الجزيئات التي سيتم تحليلها يكون لها تفاعل أقوى مع السطح ، يكون تفاعل المنظف أضعف وتبقى المادة المراد تحليلها على سطح المرحلة الثابتة لفترة أطول. كروماتوغرافيا استبعاد الحجم هي نوع آخر من كروماتوغرافيا الذي يفصل الخليط بسبب الاختلاف في حجم الجزيئات ويستند إلى عدم وجود أي تفاعلات تحليلية محددة مع المرحلة الثابتة (لا يتم استخدام القوة في هذه الطريقة). المبدأ الأساسي للفصل الكروماتوغرافي لاستبعاد الحجم(SEC) هو أنه كلما زاد حجم الجزيء ، قل احتمال اختراقه لمساحة المسام الخاصة بالممتاز ، وبالتالي قل احتمال الاحتفاظ به في العمود.
2– أنواع طرق HPLC
الأنواع الأربعة لطرق الكروماتوغرافيا المذكورة (الطور الطبيعي ، الطور المعكوس ، التبادل الأيوني واستبعاد الحجم(SEC)) هي الطرق الرئيسية الموضحة أدناه.
1-2- كروماتوغرافيا الطور الطبيعي
في كروماتوغرافيا الطور العادي ، يكون الاختلاف في قوة التفاعلات القطبية للتحليلات في خليط مع طور ثابت هو معيار الفصل. كلما كان تفاعل المرحلة الثابتة مع المادة التحليلية أقوى ، زاد الاحتفاظ بالمادة التحليلية في العمود. كما هو الحال مع أي طريقة كروماتوغرافية أخرى ، فإن عملية فصل كروماتوغرافيا الطور العادي هي أيضًا حدث تنافسي تتنافس فيه جزيئات الطور المتحرك مع جزيئات الطور المتحرك للامتصاص على سطح الطور الثابت. الطور المتحرك في كروماتوغرافيا الطور العادي عبارة عن مذيبات غير قطبية مثل الهكسان والهبتان التي يضاف إليها مذيب قطبي صغير مثل الإيثانول والميثانول. يتحكم تغيير تركيز المذيبات القطبية في الطور المتحرك في مقدار تثبيط المادة التحليلية في العمود. المضافات القطبية الشائعة هي الكحوليات (الميثانول والإيثانول والأيزوبروبانول) التي تضاف إلى الطور المتحرك بكميات صغيرة. نظرًا لأن القوى القطبية هي النوع السائد من التفاعلات وهي أقوى من غيرها ، فحتى تغيير الحجم / الحجم بنسبة 1٪ فقط للمُعدِّل القطبي في الطور المتحرك عادةً ما يؤدي إلى تغييرات كبيرة في تثبيط التحليلات.
مواد حشو العمود الشائعة في كروماتوغرافيا الطور العادي هي أكاسيد مسامية مثل السيليكا (SiO2) أو الألومينا (Al2O3). سطح هذه الأطوار الثابتة مغطى بعدد كبير من مجموعات OH التي تحافظ على هذه الأسطح في حالة قطبية عالية. يعتبر تثبيط التحليلات على هذه الأسطح حساسًا جدًا للتغيرات في تكوين الطور المتحرك. يمكن أيضًا استخدام الأطوار الثابتة المعدلة كيميائيًا أو المعدلة في الفصل اللوني للطور العادي. تعد السيليكا المعدلة باستخدام Trimethoxyglycidoxypropylsilane (الاسم الشائع: مرحلة الديول) أحد الحشوات الشائعة التي يتم فيها تقليل قطبية السطح. تتراوح كثافة سطح مجموعات OH على طور الديول بين m2/molµ 4-3 بينما في سيلانول السيليكا غير المطلي ، تبلغ كثافة السطح m2/molµ8. يؤدي استخدام الطور الثابت من نوع الديول والمركبات منخفضة القطبية كمعدلات للمنظفات (استرات مثل أسيتات الإيثيل بدلاً من الكحول) إلى عمليات فصل أفضل وأكثر قابلية للتكاثر مقارنة بالسيليكا غير المطلية.
تزداد قوة امتصاص السطح للمركبات الكيميائية في كروماتوغرافيا الطور الطبيعي بالترتيب التالي:
الهيدروكربونات المشبعة ، الأوليفينات ، العطريات ، الكبريتيدات ، الإيثرات ، مركبات النيترو ، الكيتونات الإسترات ، الألدهيدات ، الكحولات ، الأميدات ، الأحماض الكربوكسيلية.
عادة ما يعتمد اختيار استخدام كروماتوغرافيا الطور العادي كطريقة كروماتوغرافية للاختيار على قابلية ذوبان العينة في مراحل متحركة محددة. نظرًا لأنه من الشائع استخدام المذيبات غير القطبية في طريقة الطور العادي ، فإن هذه الطريقة قابلة للتطبيق على المركبات الكارهة للماء (المركبات التي تظهر تفاعلات أقوى في كروماتوغرافيا الطور العكسي) وغير قابلة للذوبان في المذيبات القطبية أو المائية. يوضح الشكل (1) تطبيق كروماتوغرافيا الطور العادي لفصل خليط من الدهون المختلفة.
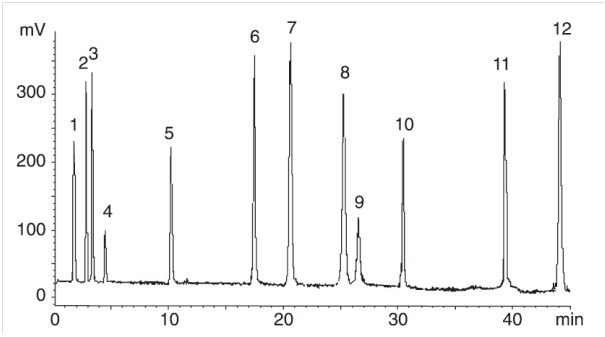
الشكل 1 – فصل العينات المختارة من فئات الدهون المختلفة: 1- بارافين ، 2- n-بالميتات- هيكساديل ، 3- بالميتات الكوليسترول ، 4- حمض ستيريك إستر ميثيل ، 5- غليسيرول ثلاثي ميتات ، 6- كحول هيكساديسيل ، 7- حامض دهني ، 8 – كوليسترول ، 9-جلسرين-1،3-ديبالميتات ، 10-جلسرين-1،2-ديبالميتات ، 11-جلسرين مونوبالميتات ، 12-إيروسيلاميد.
يستخدم العمود Licrosphere® Diol (125 × 3 مم) بقطر من جزيئات تعبئة العمود mμ-5. مذيب المنظف عبارة عن تدرج يبدأ من 100٪ أيزو أوكتان وتزداد النسبة المئوية لميثيل ثلاثي البوتيل الإيثر (MTBE) تدريجيًا حتى تصل نسبته إلى 60٪ في 34 دقيقة ثم يتم الاحتفاظ به بشكل ثابت عند هذه النسبة لمدة 10 دقائق.
2-2- كروماتوغرافيا الطور العكسي (HPLC RP أو RPLC)
على عكس كروماتوغرافيا الطور العادي ، فإن تفاعلات فان دير فالس أو التفاعلات الكارهة للماء هي القوى الرئيسية في كروماتوغرافيا الطور العكسي. في هذه الطريقة ، يتم عكس قطبية المرحلتين المتحركة والثابتة بحيث يكون سطح الطور الثابت كارهًا للماء ويكون الطور المتحرك قطبيًا (في معظم الحالات ، تُستخدم المحاليل المائية كمنظفات).
كروماتوغرافيا الطور العكسي هي الطريقة الكروماتوغرافية الأكثر شيوعًا حتى الآن ، ويتم إجراء 90 ٪ تقريبًا من جميع التحليلات لعينات الوزن الجزيئي المنخفض باستخدام كروماتوغرافيا الطور العكسي. أحد العوامل الرئيسية لشعبية هذه الطريقة وتطبيقها على نطاق واسع هو القدرة على تمييز المركبات المتشابهة جدًا وسهولة تغيير التثبيط والانتقائية فيها. سبب هذه المزايا هو أن قوى التشتت المستخدمة في هذا النوع من الفصل هي من بين أضعف القوى بين الجزيئات. هذه الطاقة المنخفضة تجعل من الممكن اكتشاف اختلافات صغيرة جدًا في التفاعلات الجزيئية لتحليلات متشابهة جدًا.
المواد الممتزة السطحية المستخدمة في هذا النوع من الكروماتوغرافيا هي مواد صلبة مسامية ذات سطح كاره للماء. معظم مواد تعبئة العمود المستخدمة في كروماتوغرافيا الطور العكسي عبارة عن سيليكا مسامية معدلة كيميائيًا. تمت دراسة خصائص السيليكا لسنوات عديدة وقد تم تطوير تقنية صنع جزيئات كروية مسامية ذات حجم ومسامية محددة بشكل جيد. على الرغم من البحث المكثف والعدد المتزايد من الأعمدة ومواد التعبئة المتاحة تجاريًا ، لا يزال هناك عدم يقين بشأن الخصائص المثلى للمرحلة الثابتة في هذا النوع من الكروماتوغرافيا لتحليل فئات متنوعة من المركبات (مثل المستحضرات الصيدلانية وسلاسل الألكيل الخطية والعطرية الحلقات والدورات غير المتجانسة/ Linear alkyl, aromatic rings and heterocycles) لا يوجد شامل.
3-2- كروماتوغرافيا التبادل الأيوني
يعمل هذا النوع من الكروماتوغرافيا على أساس عوامل الجذب المختلفة لأيونات المادة التي تم تحليلها إلى مراكز الأيونات ذات الشحنة المعاكسة في resin أو الأيونات ذات الشحنة المعاكسة الممتصة على السطح في المرحلة الثابتة الكارهة للماء. ضع في اعتبارك تبادل اثنين من الأيونات A+ و B+ في محلول و resin التبادل E–:
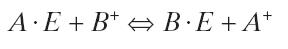
يظهر ثابت التوازن لهذه العملية في المعادلة التالية:
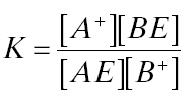
تحدد هذه المعادلة التقارب النسبي لاثنين من الكاتيونات لمراكز التبادل على السطح. إذا كان ثابت التوازن يساوي واحدًا ، فلن يكون هناك تمايز وتشخيص لهذا النظام. يشير ثابت الاتزان الأعلى من واحد إلى قدرة أكبر للكاتيون B+على استبدال A على سطح resin. وفقًا لشحنة مراكز التبادل على السطح ، يمكن أن يكون الراتنج عبارة عن مبادل أنيون (مراكز أيون موجبة على السطح) ومبادل كاتيون (مراكز سالبة على السطح).
الأنواع الأربعة الرئيسية لمراكز التبادل الأيوني شائعة الاستخدام هي:
– – SO3 : مبادل كاتيون قوي
– – CO2 : مبادل الكاتيون الضعيف
– النوع الرابع أمين: مبادل أنيون قوي.
– النوع الثالث أمين: مبادل أنيون ضعيف.
يعتمد الاحتفاظ بالتحليل والانتقائية في كروماتوغرافيا التبادل الأيوني بشكل كبير على pH الهيدروجيني والقوة الأيونية للمرحلة المتنقلة.
4-2- كروماتوغرافيا استبعاد الحجم (SEC)
كروماتوغرافيا استبعاد الحجم (SEC)هي طريقة لفصل الجزيئات بناءً على حجمها ، وكما يوحي الاسم ، يعتمد الفصل على حجم الجزيئات وممرها عبر الفضاء المسامي للمرحلة الثابتة وبسبب عوائقها الفراغية. نصف القطر الهيدروديناميكي للجزيء الذي تم تحليله هو العامل الرئيسي في تحديد معدل تثبيطه. بشكل عام ، كلما زاد نصف القطر الهيدروديناميكي للجزيء ، كلما أقصر وقت مكوثه في العمود ، تاريخيًا ، تم استخدام اسمين مختلفين لهذه الطريقة. في عام 1959 ، تم استخدام الغربلة الجزيئية لفصل البوليمرات الكيميائية الحيوية على ديكستران ، وكان يسمى كروماتوغرافيا الهلام الأملس (تم استخدام المنظفات المائية مع الأملاح كمرحلة متحركة). في عام 1961 ، تم استخدام نفس الطريقة لتحديد الوزن الجزيئي للبوليمرات الاصطناعية ، وأصبح اسم كروماتوغرافيا جل طروادة مستخدمًا على نطاق واسع بين كيميائيي البوليمرات (تستخدم المذيبات العضوية بشكل أساسي مثل THF كمنظفات.
إنها طريقة الفصل الكروماتوغرافي الوحيدة التي يجب فيها تجنب أي تفاعل إيجابي للتحليل مع المرحلة الثابتة. في كروماتوغرافيا استبعاد الحجم (SEC)، كلما زاد الوزن الجزيئي للتحلیل ، زاد نصف قطرها الهيدروديناميكي وبالتالي يمر عبر العمود بشكل أسرع. في الوقت نفسه ، إذا تفاعل جزيء التحليل مع المرحلة الثابتة (وهو أمر غير مرغوب فيه) ، فإن تثبيط الجزيئات الأكبر يزيد وقد يربك فصل الجزيئات بناءً على نصف القطر الهيدروديناميكي فقط. لهذا السبب ، يجب أن يتم اختيار حشوات العمود والمرحلة المتحركة بعناية بحيث تتفاعل جزيئات الطور المتحرك مع سطح المرحلة الثابتة أقوى من البوليمر ، مما يمنع تفاعل البوليمر مع السطح.
يعتمد تحديد الوزن الجزيئي للبوليمر على العلاقة بين نصف القطر الهيدروديناميكي للجزيء والوزن الجزيئي. يتناسب نصف القطر تقريبًا مع الجذر الثالث للوزن الجزيئي. لذلك ، فإن الجذر الثالث للوزن الجزيئي يتناسب مع معدل تثبيط المادة التحليلية. هذه العلاقة صحيحة فقط في المنطقة الكاملة لجزيئات البوليمر من الفضاء المسامي للمرحلة الثابتة.
3- جهاز HPLC
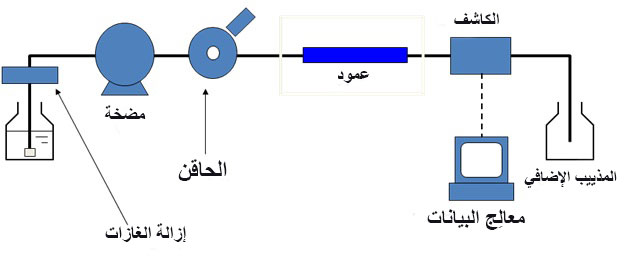
يتكون جهاز HPLC من مضخة حقن وعمود وكاشف ونظام بيانات. قلب الجهاز ركيزته. حيث يحدث الفصل العنصري. مضخة الضغط العالي مطلوبة لتمرير الطور المتحرك من خلال جزيئات الميكرومتر المسامية للمرحلة الثابتة من العمود. تبدأ العملية الكروماتوغرافية بحقن المحلول في بداية العمود. يحدث فصل المركبات عندما يتم ضخ الطور التحليلي والمتحرك في العمود. أخيرًا ، يظهر كل مركب يُستخرج في العمود كقمة على الكاشف. يعد الكشف عن المركبات المزلقة مهمًا جدًا ويمكن أن يكون انتقائيًا أو عامًا اعتمادًا على الكاشف المستخدم. يتم عرض استجابة الكاشف لكل مركب على رسم بياني أو شاشة كمبيوتر تُعرف باسم كروماتوجرام. غالبًا ما تُستخدم أجهزة الكمبيوتر والمتكاملون ومعدات معالجة البيانات الأخرى لجمع البيانات الكروماتوغرافية وتخزينها وتحليلها.
4- استخدام جهاز HPLC في تحليل جزيئات الذهب النانوية
تستخدم الجسيمات النانوية المعدنية بشكل متزايد في الفيزياء والكيمياء والبيولوجيا. لحجم هذه الجسيمات تأثير مهم للغاية على خواصها الفيزيائية والكيميائية ، بما في ذلك خصائصها التحفيزية. غالبًا ما تستخدم طريقة TEM لتحديد حجم وشكل الجسيمات. ومع ذلك ، فإن TEM هي طريقة مكلفة وتستغرق وقتًا طويلاً حيث لا يتم إجراء فصل. بالإضافة إلى ذلك ، في تحليل TEM ، يتم فحص جزء محدود فقط من العينة ولا يمكن الحصول على متوسط خصائص المادة مثل القطر والشكل. يحدث عدم اليقين الإحصائي هذا لأن الشخص هو الذي يقرر في النهاية أي منطقة من العينة يجب فحصها ، ومن المشكلات الأخرى التي تنشأ أثناء تجفيف العينة والتي يمكن أن تسبب تراكمًا أو تغيرات كيميائية ، بما في ذلك الأكسدة. أخيرًا ، منذ إجراء TEM القصف الإلكتروني ، لا يمكن ملاحظة المجموعات العضوية المستخدمة لتغطية أسطح الجسيمات النانوية ، وبالتالي لا يمكن حساب حجم الطبقة العضوية. بالنظر إلى كل هذه العوامل ، فإن الحاجة إلى استخدام طرق بديلة لتحليل حجم الجسيمات النانوية بدلاً من TEM و DLS تصبح واضحة [1].
تُستخدم طرق الكروماتوغرافيا السائلة ، التي كانت تُستخدم عادةً لفصل الجزيئات والبوليمرات بناءً على حجمها وخصائصها الكيميائية ، لتحليل توزيع حجم الجسيمات لجسيمات الذهب النانوية [1]. بالإضافة إلى ذلك ، يمكن الحصول على متوسط الحجم والخصائص البصرية لجسيمات الذهب النانوية في وقت قصير باستخدام عينة واحدة تحتوي على حجم عدة ميكرولتر [2 ، 3]. يمكن تصنيف هذه الطرق بناءً على طريقة عملها ، على سبيل المثال ، كروماتوغرافيا استبعاد الحجم [4-11] ، كروماتوغرافيا سائلة عالية الأداء [14-12] وكروماتوغرافيا التبادل الأيوني [15] من بين هذه الطرق.
نظرًا لأنه يمكن تسجيل الطيف البصري المعتمد على الحجم للجسيمات النانوية بسهولة عن طريق الأنظمة الكروماتوجرافية وأجهزة الكشف عن صفيف الصمام الثنائي ، فقد تم استخدام كروماتوغرافيا استبعاد الحجم جنبًا إلى جنب مع TEM لتحديد حجم جزيئات الذهب في النطاق من 3 إلى 20 نانومتر [16]. تم استخدام هذه الطريقة المتكاملة أيضًا لتحليل الجسيمات الغروية الأخرى مثل السيليكا [17] وأشباه الموصلات [18-21]. كروماتوغرافيا استبعاد الحجم لديها أيضًا القدرة على إنشاء أشكال أحادية الانتشار من خلال تجميع الأجزاء المنفصلة من خليط متعدد التشتت [22]. تؤكد مثل هذه التقارير أن طرق كروماتوغرافيا قادرة على فصل الجسيمات النانوية المختلفة.
يتطلب الفصل حسب طريقة استبعاد الحجم اختيار مرحلة ثابتة ذات حجم مسام مناسب ، بالإضافة إلى اختيار مرحلة متنقلة مناسبة. ومع ذلك ، فإن الامتزاز السطحي غير القابل للانعكاس للجسيمات النانوية في المرحلة الثابتة هو إحدى مشاكل استخدام الطرق الكروماتوغرافية للفصل ، كما أن مساحة السطح المرتفعة للمرحلة الثابتة والنشاط السطحي العالي للجسيمات النانوية يضاعف من مشكلة امتصاص السطح الذي لا رجعة فيه.
يمكن أن يقلل الرحلان الكهربائي الشعري (Capillary electrophoresis) من هذه المشكلة عن طريق تقليل تأثير السطح في نظام الفصل [23]. ولكن في هذه الحالة ، يعد فصل العينة للحصول على جزيئات أحادية الانتشار أحد التحديات الرئيسية. لحل هذه المشكلة في كروماتوغرافيا استبعاد الحجم ، يمكن إضافة Surfactant إلى الطور المتحرك. يرتبط Surfactantبالمرحلة الثابتة ويؤثر على سلوك التثبيط للتحليل. تُستخدم المواد الخافضة للتوتر السطحي للتحكم في حجم الجسيمات النانوية ، حيث يعمل ارتباط Surfactantمع الجسيمات النانوية على استقرارها من خلال التأثيرات الفراغية أو الكهروستاتيكية ويمنع تراكمها.
في الآونة الأخيرة ، تم فصل وتحليل جزيئات الذهب النانوية غير القابلة للذوبان (مثل جزيئات الذهب النانوية المطلية بألكانيتيولات) باستخدام كروماتوجرافيا الطور العكسي ودمجها مع كاشف مصفوفة الصمام الثنائي لتحديد أحادي الانتشار النسبي للجسيمات النانوية بحجم أقل من nm2 نانومتر [24- 28]. أيضًا ، تم استخدام كاشف قياس الجهد المتناوب للكشف عن الجسيمات النانوية الصغيرة (التي يبلغ قطرها الأساسي أقل من 2 نانومتر) والتي تم فصلها من خلال HPLC الطور العكسي.
أفاد السومالي أن عمودًا صغيرًا مساميًا كارهًا للماء يعمل بنظام كروماتوغرافيا استبعاد حجم قابل لإعادة التدوير يوفر تحليلًا عالي الدقة لجسيمات الذهب النانوية المستقرة من ألكان ثيولات والتي يقل حجمها عن nm3[29].
تعتبر طرق الفصل لتحليل جزيئات الذهب النانوية القابلة للذوبان في الماء (على سبيل المثال ، جسيمات الذهب النانوية المستقرة بالسترات) مهمة أيضًا ، والسبب في أهميتها هو تطبيقاتها التحليلية الحيوية والصيدلانية. إضافة Surfactant (على سبيل المثال ، كبريتات ديسيل الصوديوم) إلى الطور المتحرك يمنع الامتزاز السطحي لجسيمات الذهب النانوية على العمود وتراكمها ويسهل الفصل على أساس حجم الجسيمات [10].
لأول مرة ، استخدم Wei وزملاؤه طريقة كروماتوغرافيا الاستبعاد الحجمي لفصل الأشكال الكروية والقضبية المختلفة لجسيمات الذهب النانوية [30]. من بين مشاكل طريقة SEC لفصل الجسيمات النانوية هو امتصاص سطحها الذي لا رجعة فيه بواسطة حشوات العمود. تم استخدام مجموعات مختلفة من الطور المتحرك لفصل جزيئات الذهب النانوية من أجل التحقيق في مشكلة امتصاص السطح. توضح المخططات اللونية في الشكل (3) تأثير المراحل المتنقلة المختلفة. عندما يتم استخدام الماء باعتباره الشاطف الوحيد ، لا يتم ملاحظة أي ذروة ويكون امتصاص السطح شديدًا (الرسم A في الشكل 3). بإضافة SDS كمنظف ، يتم ملاحظة كلتا الرسالتين المتعلقتين بأشكال مختلفة من جزيئات الذهب في نفس النطاق (الرسم التخطيطي B في الشكل 3). باستخدام مزيج من Surfactants (SDS و Brij-35) كما هو موضح في الرسم التخطيطي C من الشكل 3 ، يمكن فصل الجسيمات النانوية الكروية والقضيب.
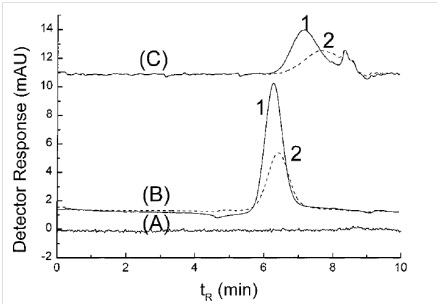
الشكل 3- كروماتوجرام لفصل أشكال مختلفة من جزيئات الذهب النانوية مع مجموعات مختلفة من المنظفات: (A) H2O و (B) mM SDS40 و (C) 35mM Brij-30 و mM SDS40. (1) كشف عند nm920 (خطوط عریضة) و (2) كشف عند nm520 (خطوط متقطعة)
بإضافة SDS إلى الطور المتحرك ، من الممكن إحداث تفاعل SDS مع المرحلة الثابتة والجسيمات النانوية. تمت دراسة التفاعل بين Surfactant والمرحلة الثابتة جيدًا [34-31]. يحدث التفاعل بين حشوات العمود والمادة الخافضة للتوتر السطحي في شكل امتزاز السطح للمادة الخافضة للتوتر السطحي على سطح الحشوات ويؤثر على كفاءة الفصل. هناك أيضًا احتمال أن يؤثر التفاعل بين الجسيمات النانوية والفاعل بالسطح على ترتيب الفاعل بالسطح حول جسيمات الذهب النانوية.
يؤدي ترتيب جزيئات SDS الكافية حول جزيئات الذهب النانوية ، والتي يتم تثبيتها بواسطة المواد الخافضة للتوتر السطحي الموجبة وتعمل كجسيمات موجبة الشحنة [34] ، إلى تغيير شحنة الجسيمات إلى سالبة. تشير البيانات إلى أن جزيئات الذهب النانوية تعمل كأنواع سالبة الشحنة في تركيز عالٍ من جزيئات SDS المركزة ، ويمكن توقع تفاعل كل من حشوات العمود وجسيمات الذهب النانوية مع SDS وتظهر شحنة سالبة على سطحها. يمنع التنافر بين الجسيمات وحشو العمود الامتزاز السطحي للجسيمات النانوية على المرحلة الثابتة لحشو العمود.
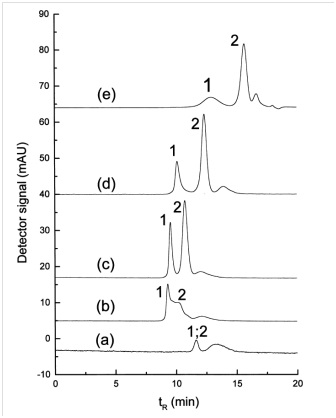
في دراسة أخرى أجراها Wei و Li Yu ، تم استخدام الفاعل بالسطح لفصل أحجام مختلفة من جزيئات الذهب النانوية. تمت مناقشة سلوك التثبيط وكفاءة الفصل في كروماتوغرافيا استبعاد الحجم لإظهار ميزة الفاعل بالسطح الأيوني في الطور المتحرك في البحث المذكور [35]. كما ذكرنا سابقًا ، فإن نوع العمود المستخدم في SEC مهم للغاية وله قيود معينة بسبب امتصاص الجسيمات النانوية عليه. على سبيل المثال ، تم استخدام أعمدة Nucleosil (500 ، 1000) لفصل جزيئات الذهب النانوية. في البحث المذكور ، يتم استخدام السترات ليس فقط كمنظف ولكن أيضًا كعامل استقرار. تسبب استخدام عمود Nucleogel مع السترات كمنظف في امتصاص السطح بشكل مكثف. وتجدر الإشارة إلى أن Nucleosil عبارة عن مادة مالئة تعتمد على السيليكا وأن Nucleogel عبارة عن بوليمر (بوليسترين-ديفينيل بنزين) وأن الشروط المستخدمة في Nucleosil ليست مناسبة ل Nucleogel حتى لو كان لديهم نفس حجم المسام وهذا يرجع إلى مشكلة الامتصاص. سطح الجسيمات النانوية على الركيزة. تم استخدام تركيزات مختلفة من محلول SDS كمرحلة متحركة لتقليل تأثير امتصاص السطح. يمكن رؤية تأثير التركيزات المختلفة لمحلول SDS كمرحلة متنقلة في الشكل (4). تظهر البيانات أنه بدون وجود SDS ، تظهر الرسائل الصغيرة ولا يحدث فصل. يزداد حجم الرسالة التي تم الحصول عليها والقرار في الفصل مع زيادة تركيز SDS.
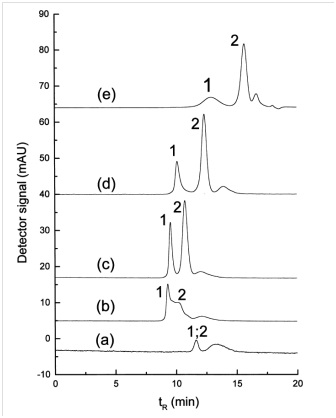
الشكل 4 – تأثير تركيز SDS على فصل جسيمات الذهب النانوية بحجم nm3/5 و nm3/38 بواسطة SEC. (a) 0، (b) 1/0، (c) 1، (d) 5 و (e) mM SDS80. (1)SDS80. (1) جسيمات الذهب النانوية nm3/38، (2): nm3/5. حجم العينة µl10ومعدل التدفق ml/min5/0.
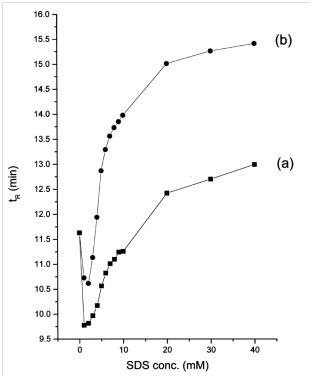
تفاوت تركيز SDS من 0.1 إلى 40 ملم للتحقيق في تأثير التركيز على وقت الغسيل (الشكل 5). أظهرت النتائج أن وقت التثبيط يتناقص مبدئيًا ويزداد عند تراكيز SDS الأعلى.
من الممكن أن تؤثر العوامل المختلفة على وقت التثبيط. عند التركيز المنخفض لـ SDS ، يحدث تفاعل SDS مع جزيئات الذهب وحشوات العمود. إن تفاعل SDS مع الحشوات التي تقلل من امتصاص السطح للذهب يقلل من وقت التثبيط ويزيد من شدة الرسالة ، كما هو موضح في الشكل (3). للتأكيد بشكل أكبر على أن تحسين الرسالة يرجع إلى الامتصاص السطحي للجسيمات النانوية على مادة تعبئة العمود ، تم تخفيف محلول الجسيمات النانوية بتركيزات مختلفة من محلول SDS بنسبة 1: 1 وتمريره عبر العمود.
يظهر طيف الامتصاص في الشكل (6) ومن الواضح أن وجود SDS يزيد من الامتصاص وهذا يؤكد أن إضافة SDS للعينة قد قلل من امتصاص السطح للجسيمات النانوية بالطور الثابت. يُعزى تحسين الرسالة التي تم الحصول عليها إلى تفاعل المادة الخافضة للتوتر السطحي مع مادة تعبئة العمود ، مما يخلق شحنة سالبة على سطح المرحلة الثابتة ويمنع امتزاز جزيئات الذهب عليها. أيضًا ، تستند نظرية كروماتوغرافيا استبعاد الحجم إلى حقيقة أن جزيئات الذهب الأكبر تمر عبر العمود بشكل أسرع ولها حجم تثبيط أقل. يؤدي انخفاض وقت الغسيل مع زيادة تركيز SDS (الشكل 3) إلى فرضية أن SDS يزيد من حجم الجسيمات وبالتالي يقلل من وقت الغسيل.
تظهر التقارير المذكورة إمكانات SEC لفصل الأشكال والأحجام المختلفة لجسيمات الذهب النانوية. يمكن حل مشكلة امتصاص السطح غير القابل للعكس لجسيمات الذهب النانوية على مواد تعبئة العمود عن طريق إضافة مواد خافضة للتوتر السطحي إلى مذيب الغسيل (على سبيل المثال ، SDS). في هذا السياق ، لزيادة كفاءة الفصل ، يجب إضافة عامل امتصاص السطح إلى العامل المكاني المتضمن في SEC. ومع ذلك ، بالنسبة للجسيمات النانوية ذات الأشكال المختلفة ، لا يمكن الحصول على خط أساس مناسب ، ولكن يمكن استخدام نظام الكشف الخاص بمصفوفات الصمام الثنائي لتفسير شكل الجسيمات النانوية. يُفضل الجمع بين DAD و SEC على TEM من حيث دراسة الخصائص الطيفية للجسيمات النانوية. ولكن لا تزال هناك حاجة لمزيد من الدراسات لتحديد آلية التفاعل بين الفاعل بالسطح وجسيمات الذهب النانوية.
المصادر و المراجع
۱ – F.K. Liu, Chromatographia 66 (2007) 791
۲ – J.P.Wilcoxon, J.E. Martin, P. Provencio, Langmuir 16 (2000) 9912.
۳ – F.K. Liu, G.T.Wei, Chromatographia 59 (2004) 115.
۴ – G.T.Wei, F.K. Liu, J. Chromatogr. A 836 (1999) 253.
۵ – Y. Mori, M. Furukawa, T.Hayashi, K.Nakamura, Particul. Sci. Technol. 24 (2006)97.
۶ – P.M. Shiundu, S.M. Munguti, S.K.R. Williams, J. Chromatogr. A 983 (2003) 163.
۷ – J.C. Giddings, Science 260 (1993) 1456.
۸ – F.K. Liu, Chromatographia 66 (2007) 791.
۹ – C.K. Lo, M.C. Paau, D. Xiao, M.M.F. Choi, Electrophoresis 29 (2008) 2330.
۱۰ – J.P.Wilcoxon, J.E. Martin, P. Provencio, J. Chem. Phys. 115 (2001) 998.
۱۱ – 12. Y. Song, M.L.A.V. Heien, V. Jimenez, R.M.Wightman, R.W. Murray, Anal. Chem. 76 (2004) 4911.
۱۲ – 13. Y. Song, V. Jimenez, C. McKinney, R. Donkers, R.W. Murray, Anal. Chem. 75 (2003) 5088.
۱۳ – V.L. Jimenez, M.C. Leopold, C. Mazzitelli, J.W. Jorgenson, R.W. Murray, Anal. Chem. 75 (2003) 199.
۱۴ – W. Bos, J.J. Steggerda, S. Yan, J.A. Casalnuovo, Inorg. Chem. 27 (1988) 948.
۱۵ – 16. G. Schmid, ClustersColloids: Theory to Applica- tions, VCH, Weinhein, 1994.
۱۶ – A. Henglein, J. Phys. Chem. 97 (1993) 5457.
۱۷ – 18. R.W. Devenish, T. Goulding, B.T. Heaton, R. Whyman, J. Chem. Soc., Dalton Trans. N5 (1996) 673.
۱۸ – 19. K.A. Littau, P.J. Szajowski, A.R. Kortan, L.E. Brus, J. Phys. Chem. 97 (1993) 1224.
۱۹ – 20. Ch.-F. Fischer, M. Giersigs, Langmuir 8 (1992) 1475.
۲۰ – T. Siebrands, M. Giersigs, P. Mulvaney, Ch.-F. Fischer, Langmuir 9 (1993) 2297.
۲۱ – J.J. Kirkland, J. Chromatogr. 185 (1979) 273.
۲۲ – Ch.-F. Fischer, M. Giersig, J. Chromatogr. A 688 (1994) 97.
۲۳ – Ch.-F. Fischer, M. Giersig, T. Siebrands, J. Chromatogr. A 670 (1994) 89.
۲۴ – A. Dass, R. Guo, J.B. Tracy, R. Balasubramanian, A.D. Douglas, R.W. Murray, Langmuir 24 (2008) 310.
۲۵ – R.L.Wolfe, R.W. Murray, Anal. Chem. 78 (2006) 1167.
۲۶ – R. Balasubramanian, R. Guo, A.J. Mills, R.W. Murray, J. Am. Chem. Soc. 127 (2005) 8126.
۲۷ – V.L. Jimenez, D.G. Georganopoulou, R.J. White, A.S. Harper, A.J. Mills, D.I. Lee, R.W. Murray, Langmuir 20 (2004) 6864.
۲۸ – A.M. Al-Somali, K.M. Krueger, J.C. Falkner, V.L. Colvin, Anal. Chem. 76 (2004) 5903.
۲۹ – G.T. Wei, F-K. Liu, C.R.C. Wang, Anal. Chem. 71 (1999) 2085.
۳۰ – T. Okada, Anal. Chem. 60 )1988) 1511.
۳۱ – W. L. Hinze, In Ordered Media in Chemical Separation; Hinze, W. L., Armstrong, D. L., Eds.; ACS Symposium Series 342; American Chemical Society: Washington, DC, 1987; pp 2-82.
۳۲ – A. Berthod, I. Girard, C. Gonnet, In Ordered Media in Chemical Separation; Hinze, W. L., Armstrong, D. L., Eds.; ACS Symposium Series 342; American Chemical Society: Washington, DC, 1987; pp 130-141.
۳۳ – W. G. Tramposch, S.G. Weber, Anal. Chem. 58 (1986) 3006.
۳۴ – G.T. Wei, F-K. Liu, J. Chrom. A. 836 (1999) 253.

